目录
- OwkinZero 在一个高质量、可验证的问答数据集上进行强化学习,证明了小而专的 AI 模型在生物学推理上,能击败更大、更通用的商业模型。
- 生成式 AI 模型 HemePLM-Diffuse,其速度比传统分子动力学快 100 倍。它不再逐帧模拟,而是直接生成蛋白质与配体相互作用的完整动态过程。
- 别再迷信复杂的模型了。真正的胜利属于混合策略:用深度学习搞定 ADME,用经典方法预测药效,但最重要的是,先把你数据里的「坑」填上。
1. AI 生物学推理:小模型击败大模型
让大语言模型(LLM, Large Language Model)回答严肃的生物学问题,常会得到一种奇特的体验。它像个博览群书、天赋过人的实习生,引经据典,头头是道,却总让人觉得它并未真正理解。它在模仿海量文本,而非进行第一性原理的科学推理。
这就是 LLM 的「生物学推理盲点」。一篇新论文,正中这个盲点。
别再奖励「花言巧语」了
过去的 AI 训练,常奖励「思考过程」(Chain of Thought)。就像老师批改作业,即使答案错误,只要解题步骤写得详细,也会给辛苦分。
OwkinZero 的研究者采用了更严格务实的方法:只奖励正确答案。
他们使用的策略是「从可验证奖励中进行强化学习」(Reinforcement Learning from Verifiable Reward, RLVR)。这好比一场永无止境的客观题考试,AI 每回答一个问题,系统就用可靠的外部知识源核对。答对得奖励,答错受惩罚。
这种直接的方法,迫使 AI 将全部精力集中于「如何得出正确结论」,而非「如何包装推理过程」。
真正的「秘密武器」:一本完美的教科书
好的考试方法需要好的教材与题库,这正是这项工作的扎实之处。
研究团队没有从互联网抓取数据,而是动员专家,构建了八个基准数据集,包含超过 30 万个高质量问答对。这些都是一线研发人员面临的真实问题:靶点成药性如何?该用小分子还是抗体?药物会引起何种细胞反应?
他们相当于为 AI 编写了一套生物医药领域最权威的教科书和模拟试卷。
结果令人大跌眼镜
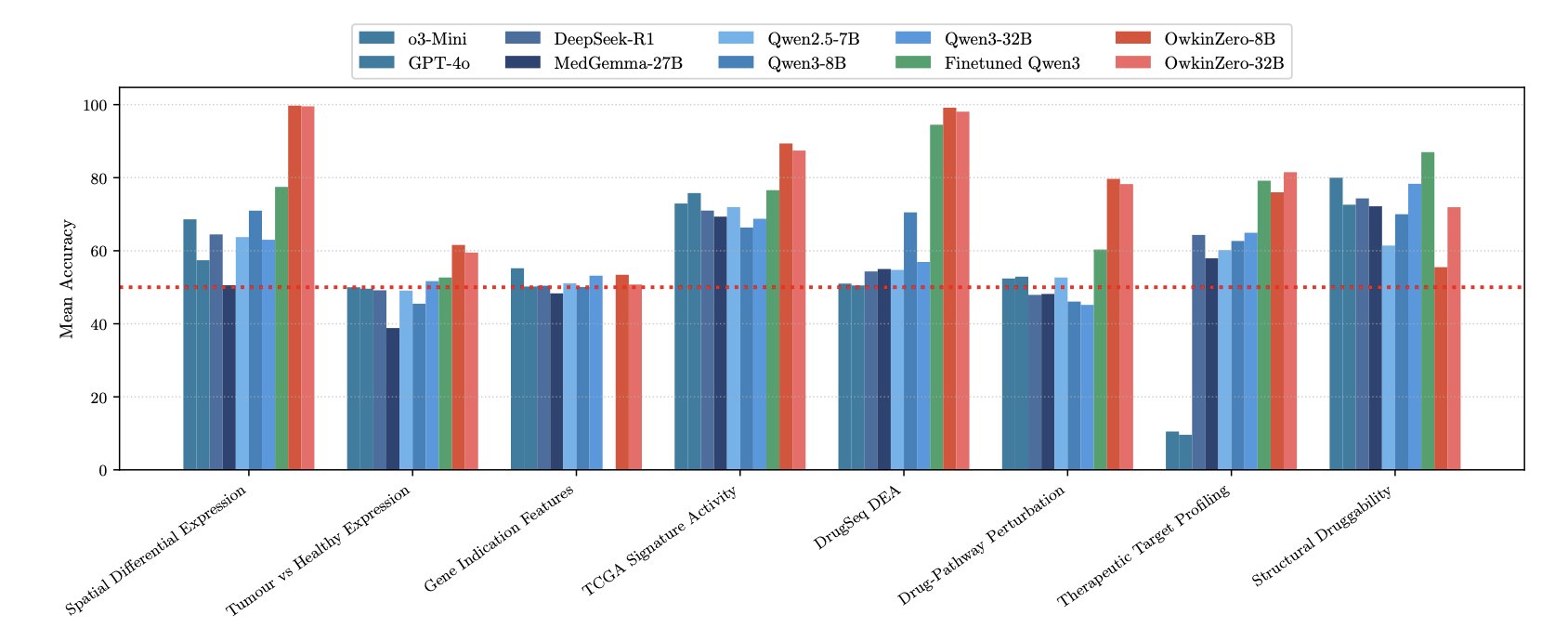
用这套方法和教材训练出的中等规模模型 OwkinZero,表现如何?
它在生物学推理任务上,稳定击败了体量和成本远超于它的通用商业大模型。
这好比一位专攻单项的运动员,在专业指导下,战胜了样样通、样样松的全能明星。
更有趣的是「泛化效应」。
研究人员发现,一个仅用「靶点成药性」题库训练的专家模型,不仅精通本行,在它从未接触过的「药物扰动效应」预测任务上,表现也提升了。
这个反直觉的结果,好比一个只上心脏病学课程的医学生,肾脏病学考试成绩也提高了。这表明模型学到的,并非孤立的心脏知识,而是贯穿医学的底层生理学和病理学原理。
OwkinZero 似乎开始真正地「思考」生物学。
也许我们无需等待无所不能的 GPT-6。利用专注、高质量的数据和恰当的训练方法,我们现在就能构建出在特定科学领域,比通用大模型更强大、更可靠的专家 AI。
📜Title: OwkinZero: Accelerating Biological Discovery with AI
📜Paper: https://arxiv.org/abs/2508.16315
2. AI 导演分子电影:比 MD 快 100 倍
跑过分子动力学 (Molecular Dynamics, MD) 模拟的人,都有过这种体验:MD 是观察分子世界的唯一「摄像机」,能让我们看到药物分子如何挤入靶点。但这台摄像机拍摄的是慢动作,续航也有限。
药物结合或解离需要微秒乃至毫秒,而超级计算机集群运行数月,也只能捕捉到几百纳秒的片段。我们手握原子级分辨率的工具,却拍不完一部完整的「电影」。
HemePLM-Diffuse 选择成为「导演」,而非「摄影师」。
AI 如何学会「执导」
优秀的导演无需亲自操作摄像机,他凭借阅片无数,理解了影像的内在逻辑。
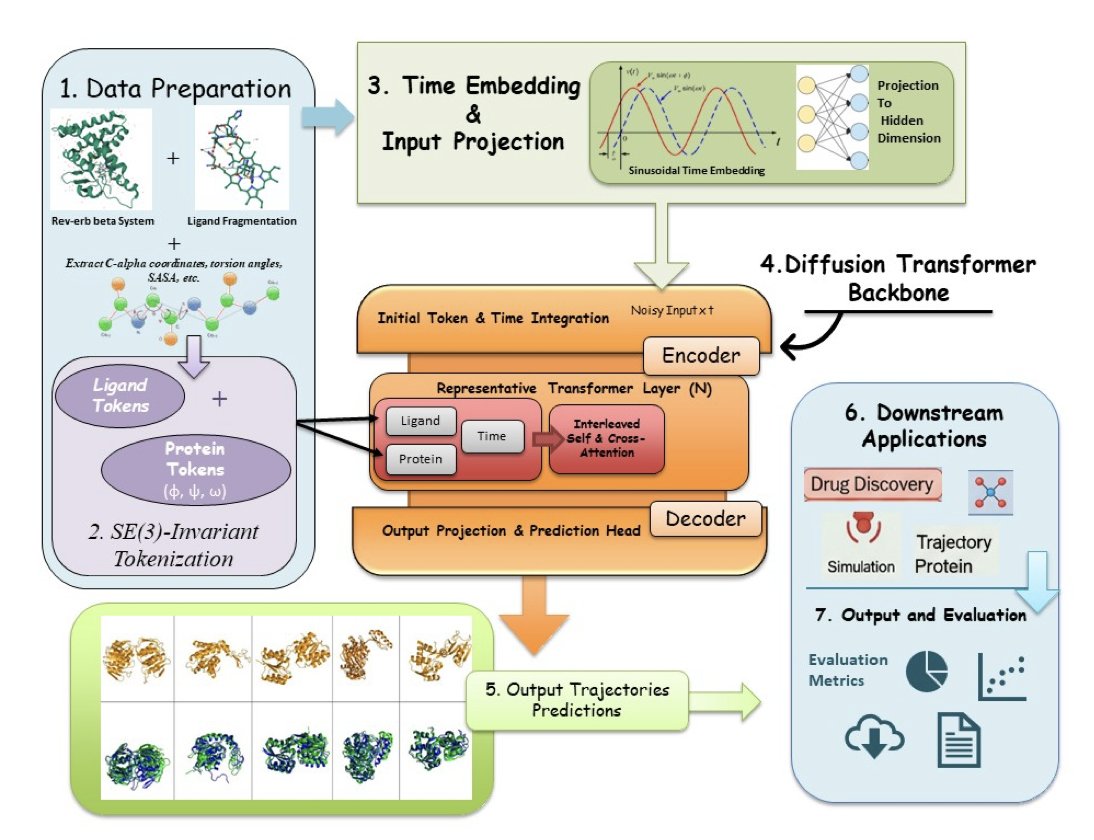
HemePLM-Diffuse,一个生成式 Transformer 模型,正是如此。它并未直接计算物理,而是学习了海量的 MD 模拟数据,从中掌握了蛋白质与配体相互作用的规律。
它知道哪些化学基团倾向于同哪些氨基酸残基相互作用,也知道柔性的环区在配体靠近时通常如何响应。
因此,不再需要逐帧拍摄。只需提供一个「剧本」——例如蛋白质 A 和配体 B 的初始和最终结合状态——AI 就能生成连接起点和终点的完整、高概率动态过程。
这个过程更接近 DALL-E 生成图像,而非物理模拟。其速度源于跳过了繁琐的逐步积分计算。
「导演」的水平如何?
为检验其可靠性,研究者在几项关键任务上对它进行了测试:
配体修复 (Ligand Inpainting) :移除轨迹中的配体,让模型将其复原。HemePLM-Diffuse 的平均 RMSD 仅为 0.91 Å,优于以往模型,证明其能准确理解配体与蛋白质的关系。
轨迹插值 (Trajectory Upsampling) :仅提供起始和结束两帧,让模型补全中间过程。它的表现同样出色,平均每帧 RMSD 为 1.03 Å,这对模拟昂贵体系很有价值。
过渡路径采样 (Transition Path Sampling) :生成从 A 状态到 B 状态的过渡路径。其 TPS 分数高达 0.95,表明生成的路径在物理上高度合理。
在速度上,模拟一个含血红素的大体系 1 纳秒的动力学过程,它仅需 12 分钟,而传统 MD 方法则需数天。超过 100 倍的速度提升带来了质变。
当前版本尚未显式地考虑溶剂(水分子)的影响,这对许多体系而言是一个简化。
HemePLM-Diffuse 开辟了一条新路径,使我们向药物设计早期阶段,就能快速、大规模预测药物动力学(而不仅是热力学)的目标更近一步。
📜Title: HemePLM–Diffuse: A Scalable Generative Framework for Protein–Ligand Dynamics in Large Biomolecular System
📜Paper: https://arxiv.org/abs/2508.16587v1
3. AI 制药对决:老方法未死,深度学习仅在 ADME 胜出
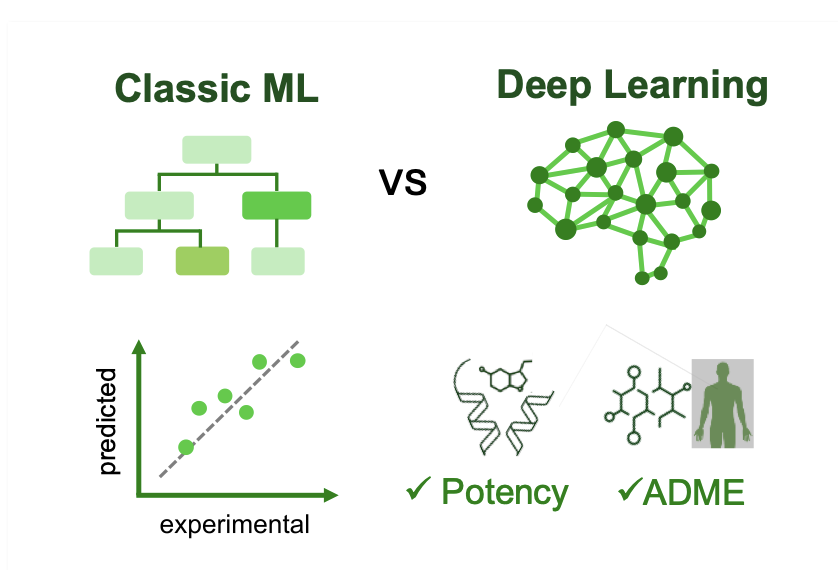
在计算药物发现领域,一场对决正在上演。一方是久经考验的经典机器学习方法,如随机森林和梯度提升机;另一方是风头正劲的深度学习,携各种复杂神经网络登场。
一篇来自「Polaris 抗病毒挑战赛」的论文,为这场对决给出了详尽的裁判报告,其结论可能让深度学习的支持者感到意外。
预测药效:老将风采依旧
在预测化合物效力 (Potency) 的核心环节,结果是平局。
经典的机器学习方法与需要巨大算力的深度学习模型表现不相上下。这说明,在预测分子与靶点结合强度这类任务上,模型的复杂程度不等于性能更优。
预测 ADME:深度学习的专场
然而,在预测药代动力学,即吸收、分布、代谢、排泄 (Absorption, Distribution, Metabolism, and Excretion, ADME) 这一更复杂的领域,深度学习取得了决定性胜利。
ADME 涉及多因素、非线性问题。一个分子的溶解度、渗透性和代谢稳定性由众多微妙的理化性质共同决定。识别这类复杂模式,正是深度学习的优势所在。
真正的「制胜秘诀」
研究发现,数据处理方法比模型选择对结果的影响更大。
关键在于处理「活性悬崖」 (activity cliffs) 现象。活性悬崖指两个化学结构几乎相同的分子,其生物活性却有天壤之别。这种数据会严重干扰模型学习。
研究者采用了一个简单的策略:训练前,识别出这些引发困惑的数据对,并暂时将其掩蔽。这一数据预处理步骤,显著提升了经典模型和深度学习模型的预测准确性。
我们与其争论哪种算法更高明,不如先花时间清理数据中的「坑」。
另一项发现是,深度学习生成的分子嵌入 (learned embeddings) 在此次挑战赛中的表现,普遍不及沿用已久的经典化学描述符。这提醒我们,新方法未必优于经过时间检验的工具。
总结而言,这场对决没有绝对的赢家。最佳策略是务实地结合两者:利用深度学习处理复杂的 ADME 预测,同时在药效预测上继续使用表现稳健的经典方法。但无论选择何种模型,首要任务都是审视并清理好你的数据。
📜Title: Deep Learning vs Classical Methods in Potency & ADME Prediction: Insights from the Polaris Antiviral Challenge
📜Paper: https://doi.org/10.26434/chemrxiv-2025-64fcb