目录
- Retro-Expert 通过强化学习,让大模型在专业模型的「沙盒」里学会了化学家的思维方式,不仅给出逆合成路线,还告诉你它为什么这么想。
- 研究者用模拟数据给变分自编码器(VAE)来了场「体测」,发现它的表现好坏,全看你喂的数据质量(比如特征纠缠度)。这篇论文就是一份 VAE 的使用和避坑指南。
- 这项研究颠覆了传统认知,证明了那些「广撒网」的分子片段并非总是坏事。它们更像一把能打开多把锁的万能钥匙,反过来揭示了不同蛋白质靶点之间隐藏的结构共性。
1. AI 化学家新范式:Retro-Expert 让逆合成可解释
市面上的逆合成 AI,像极了考试只写答案不写步骤的学生。你给它一个分子,它吐出几条路线,但你问它为什么这么解,它就给你一个高冷的背影。这让一线做实验的化学家很头大:谁敢拿经费和头发陪一个无法解释自己的黑箱去赌?
Retro-Expert 试图解决这个信任危机。
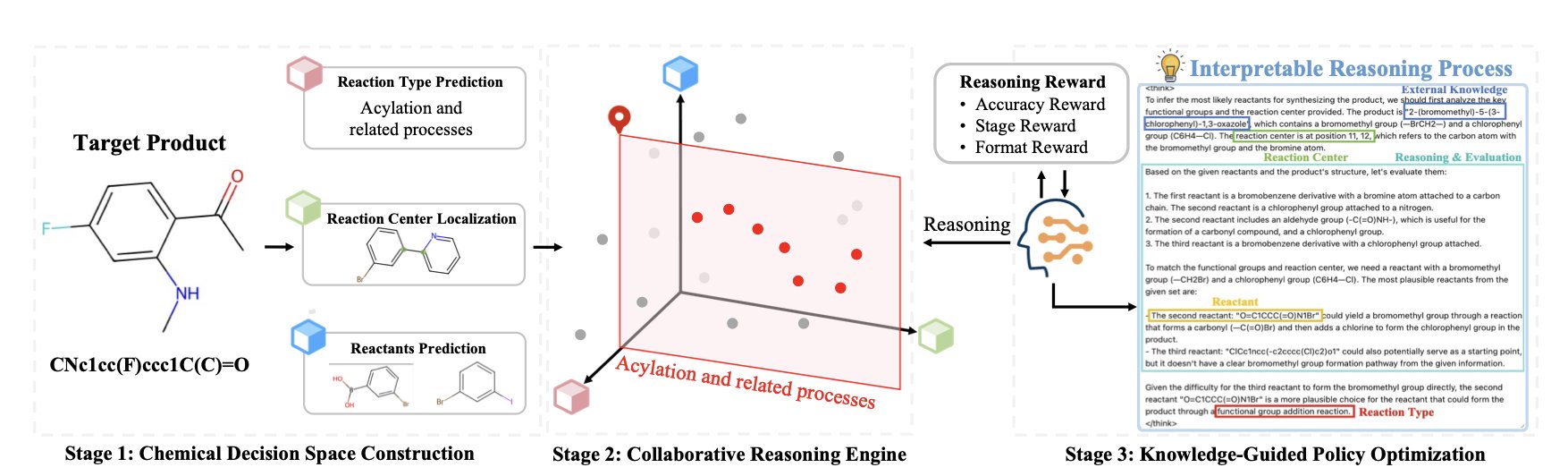
研究者组建了一个「专家组」,成员是几个在特定反应类型上训练有素的专用模型。这些专家负责头脑风暴,提出各种可能的反应切断方式,构建出一个高质量的化学决策「沙盒」。然后,主角——一个大语言模型 (Large Language Model, LLM) 登场。它的任务不是从零开始蛮干,而是像个经验丰富的项目组长,在沙盒里推理决策,找出最高效的合成路径。
这里的精髓是强化学习 (Reinforcement Learning, RL)。这套方法好比训练围棋 AI,不靠死记硬背棋谱,而是在一次次对弈中,自己领悟制胜之道。Retro-Expert 里的大语言模型也是如此,它在化学决策空间里不断试错,如果选择的路径最终导向一个准确又逻辑自洽的方案,就会获得奖励。久而久之,它就学会了像化学家一样思考,懂得什么反应在特定环境下更靠谱,哪些官能团凑在一起会「打架」。
这样做的好处很直接。首先,模型终于肯开口了。它不再只甩给你一张冷冰冰的反应物清单,而是会附上一段基于化学原理的解释,比如:「我选择在这里切断,因为这是个经典的 Wittig 反应,底物好买,反应条件也温和。」这种坦诚,是化学家与 AI 建立信任的基础。
其次,这个框架很灵活。化学知识日新月异,新反应层出不穷。Retro-Expert 的模块化设计,意味着有了更好的「专家模型」,可以直接插进来升级系统,不必推倒重来。在快节奏的药物研发领域,这是一个巨大的工程优势。
当然,只在计算机上跑得好还不够。研究者们穿上白大褂,用湿实验验证了模型。他们不仅成功合成了一个文献里查无此人的分子,还为另一个已知分子找到了一条全新的合成路线。
📜论文标题:Retro-Expert: Collaborative Reasoning for Interpretable Retrosynthesis
📜论文地址:https://arxiv.org/abs/2508.10967v1
2. VAE 多组学整合:别急着用,先看看这份「避坑指南」
现在搞生物医学研究的,手里没几个「组学」数据,都不好意思跟人打招呼。基因组、转录组、蛋白质组、代谢组……数据维度越来越多。怎么把这些五花八门的数据整合起来,挖出有用的生物学规律,是计算生物学领域的头号难题之一。
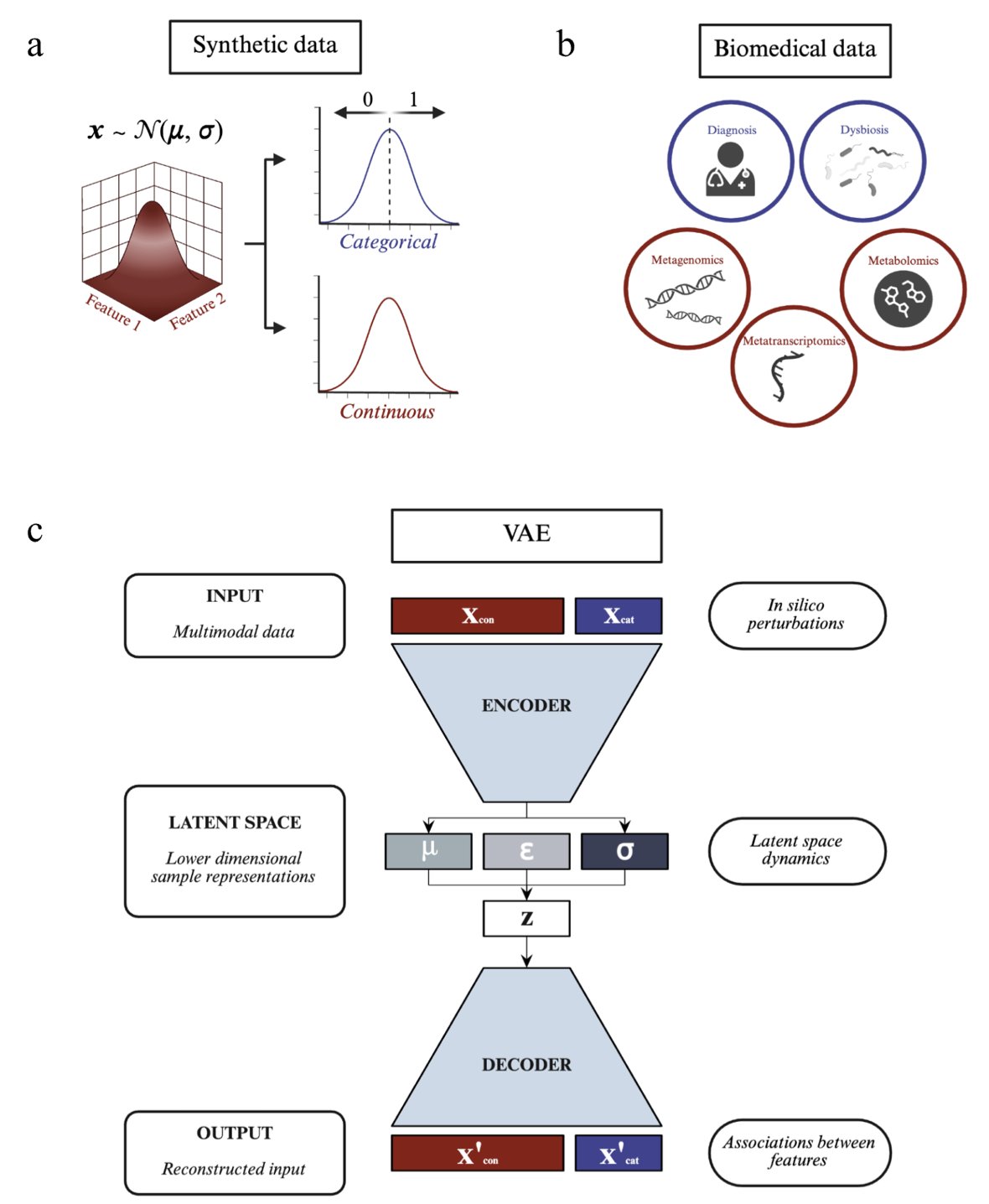
变分自编码器(Variational Autoencoder, VAE)就是解决这个问题的工具之一。你可以把它想成一个超级「数据压缩机」,能把高维复杂的多组学数据,压进一个更本质的低维「潜在空间」。理论上,在这个空间里,样本关系一目了然,我们甚至能做「虚拟实验」(in silico perturbations)——比如,在电脑里模拟调高某个基因的表达,看看哪个代谢物会跟着起哄。
听起来很美。但现实中,我们常常把 VAE 当成黑箱来用。模型跑完,结果给你了,但这结果靠不靠谱?模型的表现,是算法的锅,还是数据的锅?大家心里都没底。
这篇论文就给这个「黑箱」砸开一道缝,让我们瞅瞅里面到底啥情况。
用「合成数据」来建立「标准答案」
研究者没有一头扎进复杂的真实生物数据里,因为在真实数据中,我们永远不知道「标准答案」是什么。
所以,他们先自己动手,造了一系列「合成数据集」。在这些数据集里,变量间的关系是他们提前设定好的,也就是已知的「标准答案」。这就像出卷老师自己先做一遍卷子,手里捏着标准答案。
然后,他们用这些合成数据,去系统地「拷问」多模态 VAE 模型:
几个关键的实践启示
通过这些严谨的基准测试,研究者们得出了一些指导意义的结论:
1. 数据质量是王道 :模型的重建能力,和数据本身的属性(比如特征纠缠度、样本/特征比)高度相关。把数据扔给模型前,先花时间理解和预处理数据,比瞎调模型参数管用得多。
2. 「虚拟扰动」要小心用 :他们把「虚拟扰动」的方法,从只能处理基因敲除这类离散变量,扩展到了能处理蛋白质或代谢物浓度变化等连续变量。这更贴近生物学的真实情况。
3. 需要更鲁棒的评估方法 :他们发现,传统的统计检验在评估「虚拟扰动」效应时,容易报假警(假阳性)。因此,他们提出了一种更可靠的量化新方法。
最后,他们把从合成数据里学到的经验,应用到真实的炎症性肠病(IBD)多组学数据集上,展示了这套框架在解决实际问题中的潜力。
这项工作就像一份严谨的「用户手册」或「实验报告」。VAE 这个工具很好,但在用之前,最好先摸清它的脾气。
📜Paper: https://doi.org/10.1101/2025.08.18.670835
💻Code: https://github.com/Simon-Rasmussen-Lab/MOVE
3. 分子「海王」的自我修养:药物设计里的 Bug 还是 Feature?
在药物发现领域,「滥交」(promiscuous)这个词,绝对是项目负责人的「血压飙升器」。它和「毒性」、「不溶」一起,常年霸占「千万别用这些词形容我的候选化合物」排行榜前三。一个滥交的分子,就像个社交花蝴蝶,在细胞里四处「放电」,结合一堆本不该碰的靶点,通常是通往脱靶效应、毒副作用和项目失败的单程票。
所以,我们向来对这类分子唯恐避之不及。
但这篇 ChemRxiv 上的预印本,却问出了一个反常识的问题:在我们把这些「花蝴蝶」扔进垃圾桶前,能不能先听听它们想说什么?
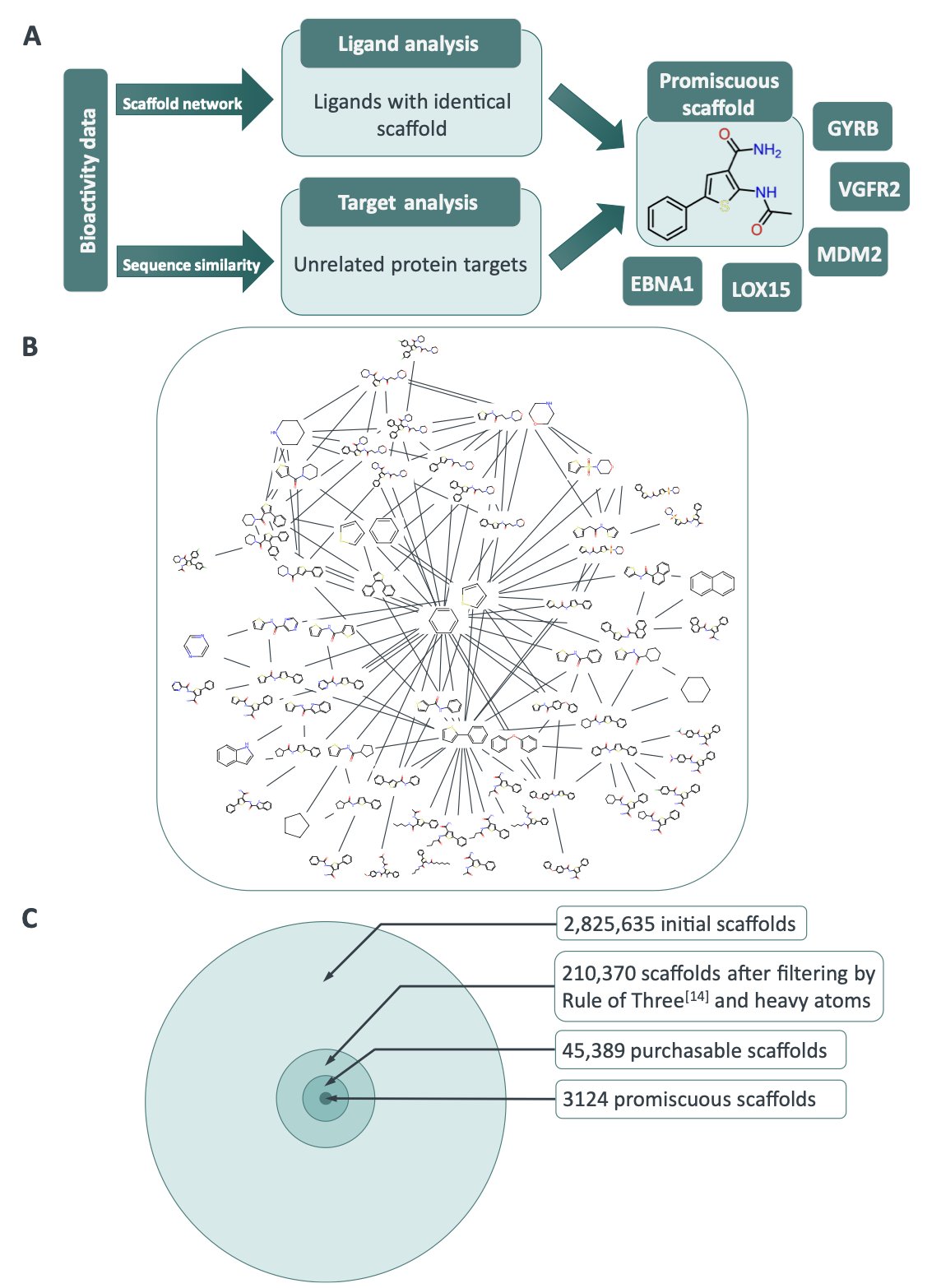
作者先是从 ChEMBL 这个巨大的数据库里,系统性地揪出了 3124 个有「前科」的化学骨架。然后,他们深入研究了其中一个:苯基噻吩类骨架。它能同时结合五种完全不同的蛋白质。
通过对接模拟,他们发现,这五个风马牛不相及的蛋白质,竟然共享着一个相似的疏水性「子口袋」。
这个滥交的片段,就像一把能打开五扇门上五把不同锁的万能钥匙。它能做到这一点,是因为这五把锁虽然外观、功能各异,但内部的「锁芯」结构竟然是相似的。这个片段,无意中发现了蛋白质世界里的一条「通用漏洞」。
这一下,故事的性质就变了,从一个坏消息,变成了一个好消息。
如果这是一个通用漏洞,我们是不是可以拿着这把万能钥匙,去主动寻找其他装有类似「锁芯」的门?
他们就是这么做的。研究者拿着这个苯基噻吩的结构,在整个 PDB(蛋白质结构数据库,Protein Data Bank)里筛选,寻找其他拥有类似「子口袋」的蛋白质。结果,他们找到了一个意想不到的新靶点——来自寄生虫克氏锥虫的克鲁斯蛋白酶(Cruzipain)。
到这里,这还是个计算化学的好故事。但他们紧接着回到实验室,在试管里验证了这个预测。结果证实,这个片段确实能抑制克鲁斯蛋白酶的活性。
这为从事基于片段的药物设计(Fragment-based Drug Design, FBDD)的研究者,提供了一套全新的「狩猎」策略。过去,我们先确定一个猎物(靶点),再去武器库(片段库)里寻找能打中它的子弹。现在,我们可以反过来,先从那些最「滥交」、命中率最高的「子弹」出发,看看它们到底能打中哪些不同的猎物。这是一种从化学空间出发,反向探索生物学空间的全新思路。
但这还没完。这套策略最精妙的收尾在于:一旦你理解了你的片段为何滥交(因为它完美契合了那个广泛存在的「通用锁芯」),你就可以在把它「生长」成一个完整药物分子时,有意识地让新加上去的「胳膊」和「腿」,去与你真正想要的那个靶点上、那些独一无二的区域相互作用。
你利用了它的滥交性来帮你「敲开大门」,然后再通过理性设计赋予它专一性,确保它只待在正确的房间里。
所以,「滥交」,到底是 Bug 还是 Feature?这取决于你想从它身上得到什么。你觉得呢?
📜Title: Promiscuous scaffolds: Friend or foe in fragment-based drug design?
📜Paper: https://doi.org/10.26434/chemrxiv-2025-bmv1h