目录
- BOLD-GPCRs 最厉害的地方在于,它不只预测小分子活性,还能告诉你蛋白上的突变会如何改变功能,这对于攻克 GPCR 靶点价值连城。
- AttriLens-Mol 用强化学习给 AI 戴上了“化学家眼镜”,迫使其在预测前先识别关键分子特征,让结果不仅准,还可解释。
- AI 药物设计“梦之队”在猛攻单一目标时表现惊人,但会牺牲成药性,暴露出专家团队和全能通才之间的矛盾。
1. AI 解锁 GPCR:预测突变,指引药物开发
GPCRs,A 类 GPCRs。对于药物研发人员而言,这几个字母代表着超过一半的上市药物,同时也意味着无尽的困扰。这些蛋白质宛如一缕柔软的意大利面,嵌入细胞膜中,构象变化丰富,还喜欢进行“偏向性激动”等复杂操作,使得针对它们的研究变得更加困难。
现在市面上的 AI 预测模型,大多是让你输入一个分子,它吐出一个活性值。这当然有用,但对于 GPCR 来说远远不够。因为 GPCR 的功能和药物响应,与它自身的序列,特别是单个氨基酸的突变,密切相关。很多疾病就是因为 GPCR 上的一个点突变引起的。
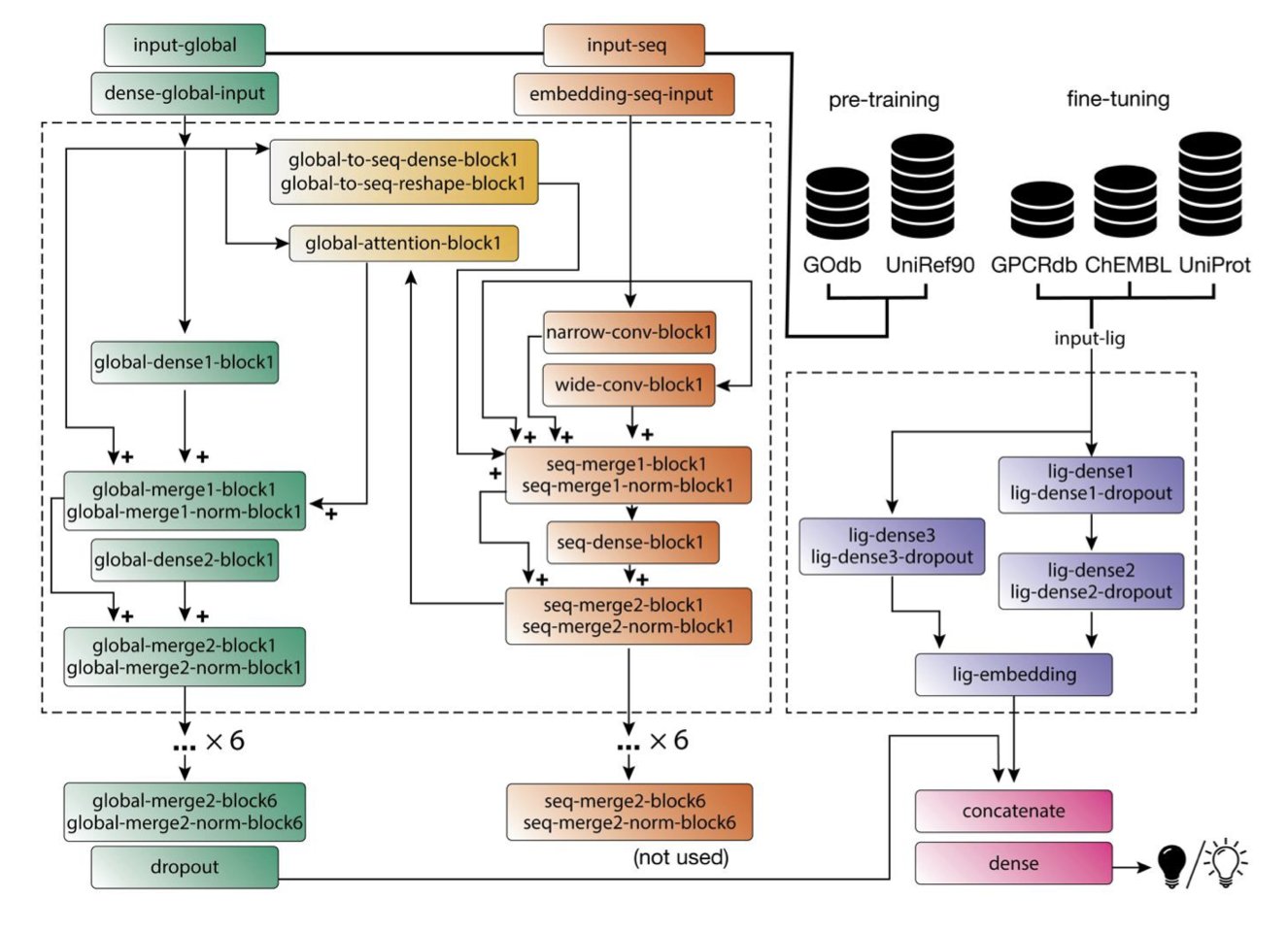
BOLD-GPCRs 的聪明之处就在于,它把蛋白质和配体这两个变量都放进了模型的核心。
它用的方法:
- 读懂蛋白质:它用了一个叫 ProteinBERT 的 Transformer 模型来处理 GPCR 的序列。这和那些只把氨基酸当成独立字母的模型不一样。Transformer 能理解上下文,它知道一个残基在序列中的位置和周围的“邻居”会如何影响它的功能。它是在“阅读”蛋白质的语言。
- 理解小分子:对于配体,它没有走什么花里胡哨的路线,而是用了很经典的物理化学性质嵌入。这就像给分子画了一张精准的“化学身份证”,描述了它的大小、形状、电荷分布等。
然后,它把这两部分信息融合在一起进行训练。这就好比让一个顶尖的结构生物学家(懂蛋白)和一个经验丰富的药物化学家(懂小分子)坐下来一起开会,而不是各说各话。
这种设计带来了两个好处。
首先,它能预测特定突变对药物活性的影响。这对我们来说意味着什么?我们可以直接在电脑上问:“如果病人的这个 GPCR 有了这个突变,我手头的这个候选药物还有用吗?活性会变强还是变弱?”这在开发针对特定基因型患者的精准药物时,简直是神器。
其次,就是它的可解释性。通过模型的“注意力机制”,我们可以看到在做预测时,AI 到底在“看”蛋白质的哪些部分。如果它在预测一个激动剂活性时,注意力高度集中在已知的关键激活残基上,那我们对这个预测结果的信心就会大增。这对于药物化学家来说,就等于拿到了一张靶点结合口袋的“热力图”,指导我们下一步该如何修饰分子结构。
当然,这终究是个计算模型,所有的预测最终都要回到湿实验室里去验证。而且,这个模型目前还没有整合三维结构信息,这无疑是未来可以提升的重要方向。
📜Title: BOLD-GPCRs: A Transformer-Powered App for Predicting Ligand Bioactivity and Mutational Effects Across Class A GPCRs
📜Paper: https://www.biorxiv.org/content/10.1101/2025.08.04.668547v1
2. 让 AI 不再瞎猜:教它像化学家一样思考
跟 AI 模型打交道,最头疼的是什么?是它们的“黑箱”属性。一个模型告诉你这个分子的溶解度是 -3.5,另一个说是 -4.2。谁对?为什么?天知道。它们就像个会算命但从不解释卦象的算命先生,你用着心里总发毛。
这篇 AttriLens-Mol 的论文,就是冲着解决这个核心痛点来的:在让 AI 预测结果之前,先逼它“讲理由”。
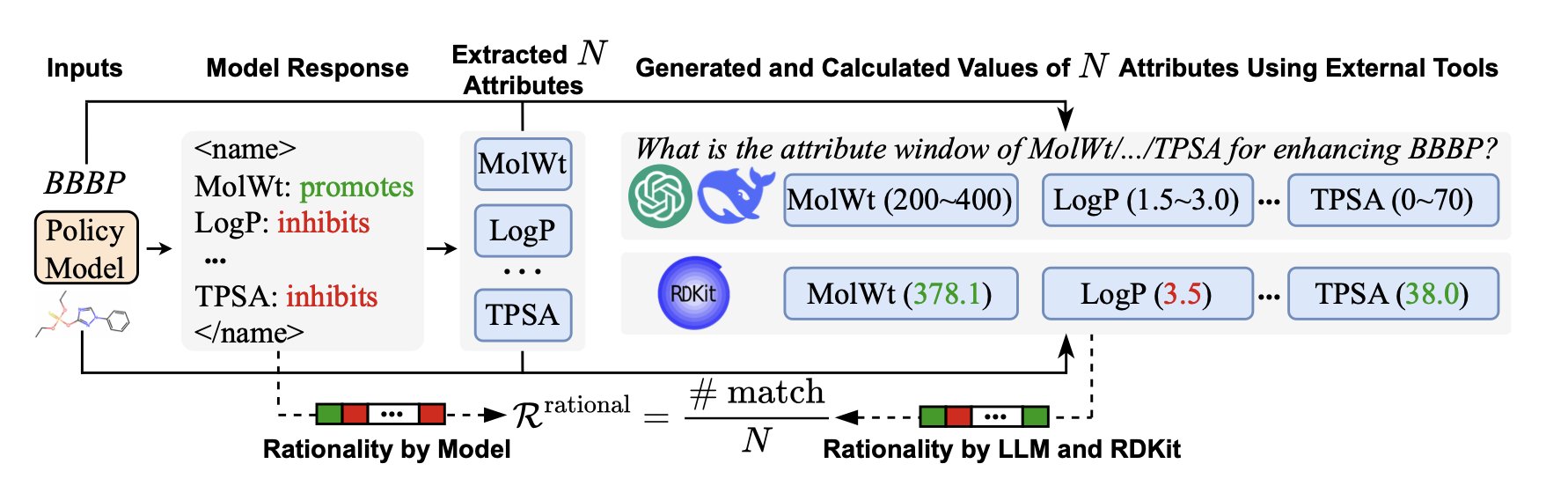
这个框架的精髓在于“属性引导强化学习”。就是你不能直接给我一个数字,你得先告诉我,你是基于分子上的哪些官能团、哪些结构片段,才得出这个结论的。比如,在预测一个分子的水溶性时,AI 必须先学会识别出分子里有几个羟基、几个羧基,或者有没有一大块油腻腻的芳香环。
这听起来很棒,但怎么实现呢?
靠的是强化学习里的奖励机制:
- 格式和字数奖励:这是基础。要求 AI 的回答得有条理,不能啰里啰嗦,直奔主题。
- 理性奖励 (Rationality Reward):神来之笔。AI 提出一个它认为相关的分子特征后,系统会立刻“请外援”来做交叉验证。这个外援可能是 RDKit 这样的老牌化学信息学工具,也可能是 GPT-4o 这种更强大的“老师”模型。如果 AI 说的特征符合化学常识,就给奖励;如果它开始胡扯,比如把一个烷烃说成是亲水的,那就得挨罚。
好比训练一个新手化学家。你不仅要看他实验做得对不对,还要听他解释为什么要这么做。如果他能说出个一二三,而且逻辑自洽,那他才是真的学会了。
效果出人意料地好。一个只有 70 亿参数的“小”模型(比如 Qwen2.5 或 LLaMA3.1),经过 AttriLens-Mol 这么一调教,在分子属性预测任务上的表现,居然能跟 GPT-4o 和 DeepSeek-R1 这些庞然大物打个平手,甚至在某些数据集上反超。这对于没有无限计算资源预算的实验室来说,简直是天大的好消息。
更重要的是,我们得到了梦寐以求的“可解释性”。因为 AI 输出的不仅仅是一个预测值,还附带了一份“推理报告”。我们可以清楚地看到,AI 是因为注意到了分子中的某个特定片段,才做出了相应的判断。研究者们甚至把这些 AI 提取出的特征,喂给一个简单的决策树模型,发现效果比传统方法生成的特征要好得多。
📜Title: AttriLens-Mol: Attribute Guided Reinforcement Learning for Molecular Property Prediction with Large Language Models
📜Paper: https://arxiv.org/abs/2508.04748v1
3. AI 组团药物开发:人多力量大还是添乱?
这篇论文探讨一个问题:怎么组织和管理这些 AI,让它们像一个高效的研发团队一样工作?
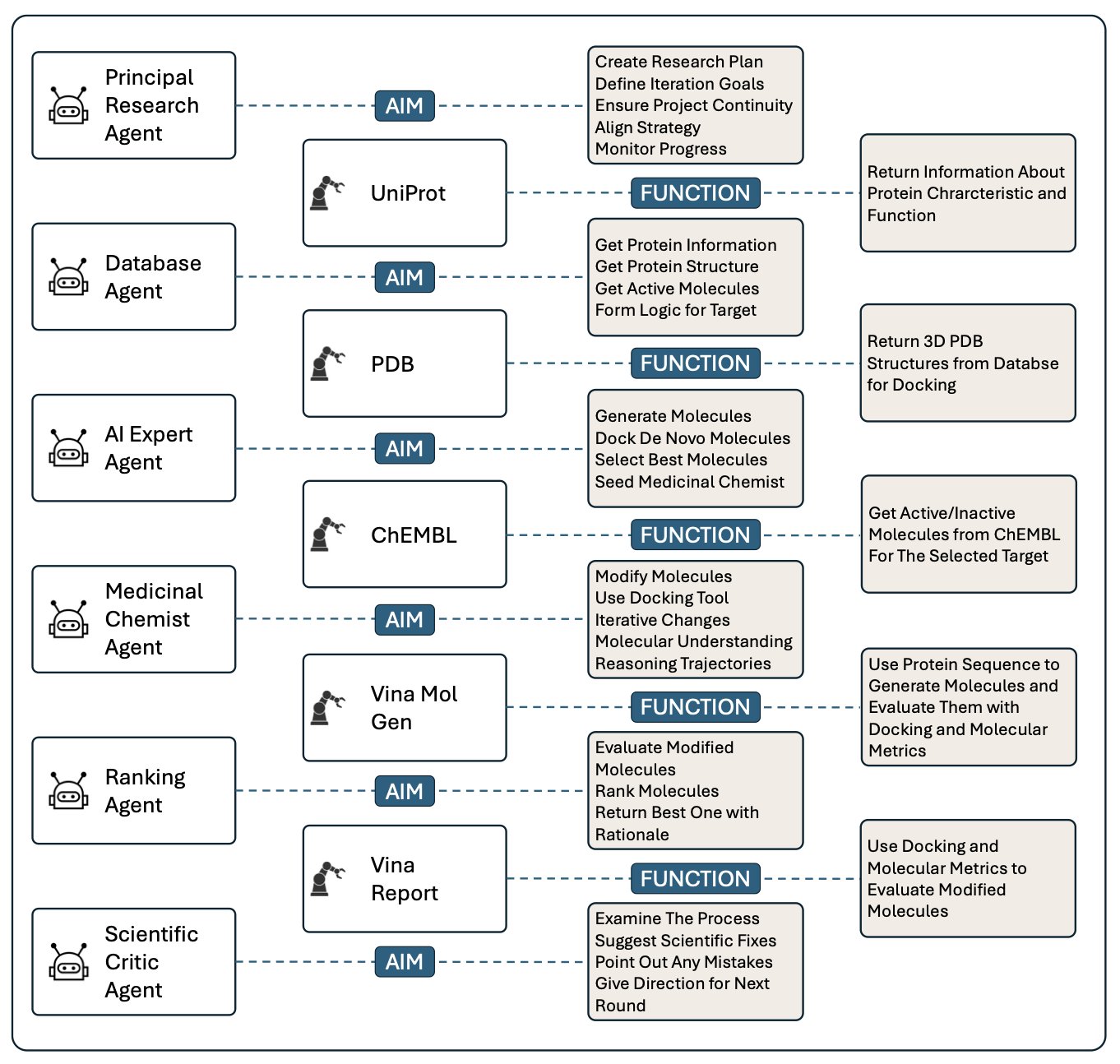
研究者们搭建了一个相当豪华的“AI 委员会”。这里面有:
* 首席研究员 (Principal Researcher):项目经理,负责统筹全局。
* 数据库专员 (Database Agent):负责从文献库里挖信息。
* AI 专家 (AI Expert):玩转各种生成模型,负责出点子。
* 药物化学家 (Medicinal Chemist):像我们一样,盯着分子结构,评估可行性。
* 排序专员 (Ranking Agent):负责给候选分子打分排队。
* 科学评论员 (Scientific Critic):一个永远在抬杠的角色,负责挑刺和质疑。
这不就是我们每天开项目会时的场景吗?只不过这次,参会的都不是人。
他们拿这套系统去死磕 AKT1 这个老靶点。结果呢?这个“AI 梦之队”确实给力,跟单个 AI 单打独斗相比,它把预测的结合亲和力硬生生提高了 31%。这说明,把一个复杂任务拆解开,让不同的“专家”Agent 去处理,确实能把一件事做到极致。
但反转来了,这也是这篇工作最有趣的地方。当研究者们审视这些被优化出来的分子时,他们发现,“梦之队”的作品虽然结合力强,但在整体成药性上,反而不如那个“孤胆英雄”式的单 Agent 生成的分子。
这简直是药物研发日常的复刻。一个团队里,做构效关系的化学家拼命把活性往上推,结果做 ADMET 的同事跳起来说:“你这分子溶解度差得像块砖头,根本没法成药!”这个 AI 系统恰恰暴露了这种“局部最优不等于全局最优”的困境。
多 Agent 团队就像一群专家,每个人都想在自己的领域做到 100 分,结果合成了一个“科学怪人”。而那个单 Agent,就像一个经验丰富的老化学家,脑子里时刻有一杆秤,在活性、溶解度、代谢稳定性之间不断权衡。
这个系统最大的价值可能不是那 31% 的提升,而是它那个“可审计性” (Auditable) 的设计。系统会把所有 Agent 之间的“对话”和决策过程全部记录下来。这简直太重要了!我们终于不用再对着一个 AI“黑箱”许愿了。我们可以像看项目会议纪要一样,回溯整个设计过程:AI 专家提出了哪个疯狂的想法?药物化学家 Agent 是基于哪条规则否决了它?这个功能让 AI 从一个猜谜游戏,变成了一个可以理解、可以信任、可以验证的科学工具。
这套系统还需要进化。下一步是给它装上更多的“武器”,比如 ADMET 和选择性预测工具。
📜Title: An Auditable Agent Platform for Automated Molecular Optimisation
📜Paper: https://arxiv.org/abs/2508.03444